三迭紀3D打印新藥胃滯留產品T22(利奧西呱胃滯留緩釋膠囊)獲批NMPA IND
2025年5月19日,三迭紀宣布國家藥品監督管理局(NMPA)正式批準了公司3D打印胃滯留產品T22(利奧西呱胃滯留緩釋膠囊)的新藥臨床試驗申請(IND)。此前,該產品已于2024年1月獲得美國食品藥品監督管理局(FDA)的IND批準。隨著T22的IND獲批,基于三迭紀3D微結構胃滯留平臺開發的兩款產品T20G與T22,均已在中美兩國進入臨床階段。
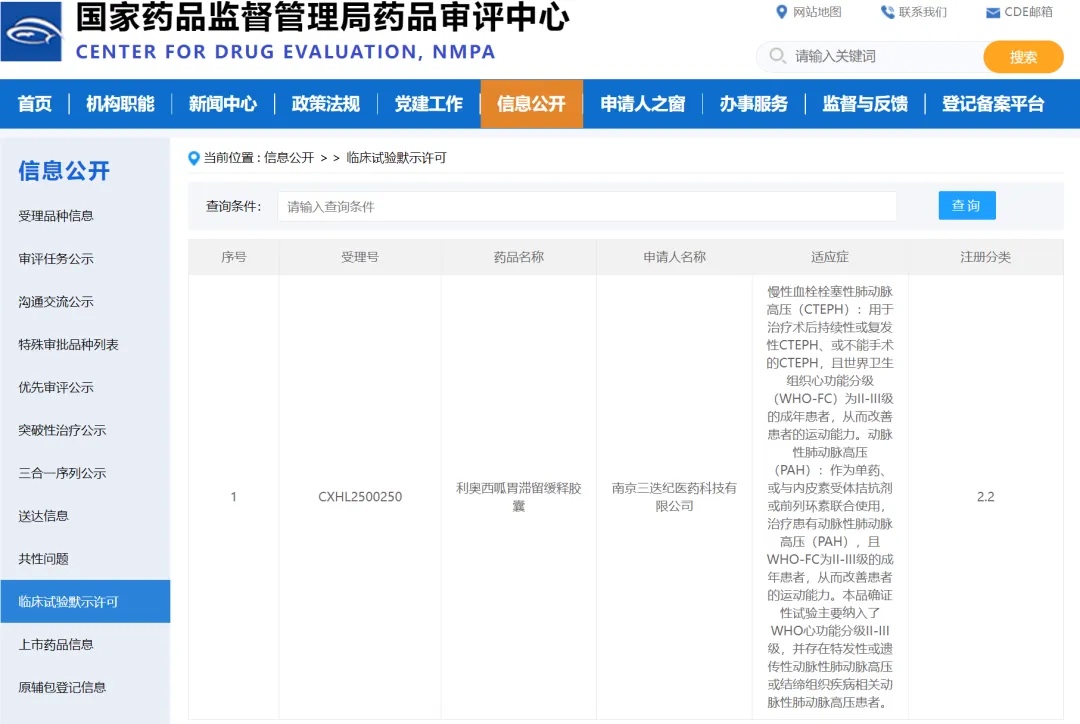
今年5月5日是第14個“世界肺動脈高壓日”。肺動脈高壓(PH)作為一種常見的血流動力學異常狀態,其病情進展迅速,致死率、致殘率高,被醫學界稱為“心血管系統的惡性腫瘤”。PH在臨床上有多個分類,其中動脈性肺動脈高壓(PAH)患者在靶向藥問世前預后極差,中位生存期僅為2.8年[1];慢性血栓栓塞性肺動脈高壓(CTEPH)患者如未得到適當治療,重癥患者(平均肺動脈壓>50mmHg)的5年生存率僅為10%[2]。
利奧西呱是一款可溶性鳥苷酸環化酶(sGC)激動劑,于2013年10月在美國上市,并于2017年9月進入中國市場,用于靶向治療PAH和CTEPH。目前,利奧西呱仍然是唯一獲批用于治療CTEPH的靶向藥物。由于利奧西呱的半衰期較短,因此患者需要每日服藥3次。
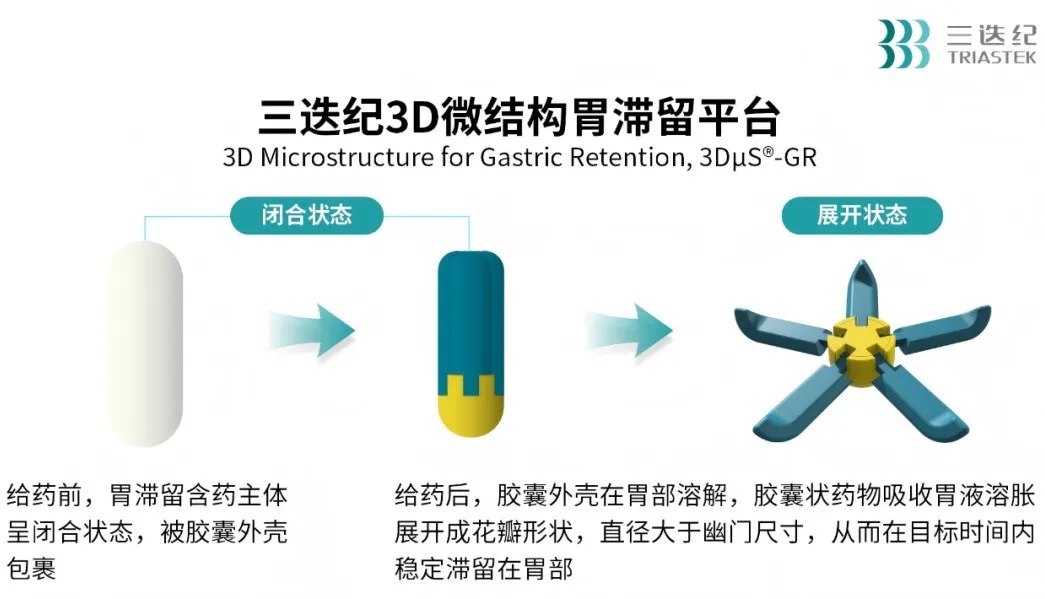
三迭紀T22利奧西呱胃滯留緩釋膠囊是一款2.2類改良型新藥產品[在美國的申報路徑為505(b)(2)],采用三迭紀創新的熔融擠出沉積聯合微注射成型工藝(Melt Extrusion Deposition plus Micro-Injection Molding, MED&MIM),并基于3D微結構胃滯留技術平臺(3D Microstructure for Gastric Retention, 3DμS®-GR)開發而成。相較于原研產品的每日3次給藥,T22將給藥頻率降至每日1次,簡化給藥方案,提高患者用藥依從性。

隨著T20G和T22在中美兩國相繼獲批進入臨床階段,標志著3D微結構胃滯留平臺的技術成熟度獲得進一步驗證。未來,我們將加速推進兩款產品的臨床開發,為全球患者提供更優質的藥物產品。
參考文獻:
[1] D'Alonzo GE, Barst RJ, Ayres SM, et al. Survival in patients with primary pulmonary hypertension. Results from a national prospective registry[J]. Ann Intern Med, 1991, 115(5): 343-349.
[2] Kim NH, Delcroix M, Jais X, et al. Chronic thromboembolic pulmonary hypertension[J]. Eur Respir J, 2019, 53 (1): 1801915.
(責任編輯:admin)


 Damen和CEAD合作開發3D打
Damen和CEAD合作開發3D打 NASA與ICON聯手推進太空3D
NASA與ICON聯手推進太空3D 第八屆醫院3D打印論壇:個
第八屆醫院3D打印論壇:個 3D打印巨頭Stratasys收購
3D打印巨頭Stratasys收購 Nature子刊:3D打印技術助
Nature子刊:3D打印技術助 美國空軍2860萬美
美國空軍2860萬美 美國軍工企業強強
美國軍工企業強強 美國斥資450萬美
美國斥資450萬美 GoEngineer通過收
GoEngineer通過收 3D食品打印:烹
3D食品打印:烹 卡內基梅隆研究人
卡內基梅隆研究人

