全球與中國(guó)3D打印融合器市場(chǎng)現(xiàn)狀及未來(lái)發(fā)展趨勢(shì)
時(shí)間:2022-09-22 10:40 來(lái)源:智研瞻產(chǎn)業(yè)研究院 作者:admin 閱讀:次
近年來(lái),3D打印技術(shù)興起和成熟,在骨科椎間融合器領(lǐng)域的應(yīng)用也嶄露頭角。相比傳統(tǒng)設(shè)計(jì),3D打印椎間融合器有利于骨融合的多孔結(jié)構(gòu),增強(qiáng)放射成像特性,使融合可視化的開(kāi)放式設(shè)計(jì)。目前椎間融合器已成為3D打印技術(shù)在骨科植入物制造領(lǐng)域產(chǎn)業(yè)化推進(jìn)速度最快的領(lǐng)域之一。
3D打印融合器行業(yè)目前現(xiàn)狀分析
統(tǒng)計(jì)數(shù)據(jù)顯示,2017年中國(guó)3D打印融合器市場(chǎng)規(guī)模4149.50萬(wàn)元,到2021年中國(guó)3D打印融合器市場(chǎng)規(guī)模8411.19萬(wàn)元,增長(zhǎng)率18.99 %。2017-2022年中國(guó)3D打印融合器市場(chǎng)規(guī)模如下:

打印融合器產(chǎn)業(yè)鏈分析

3D打印融合器行業(yè)發(fā)展面臨的風(fēng)險(xiǎn)
中國(guó)醫(yī)療3D打印面臨的政策困境
對(duì)比國(guó)外,中國(guó)其實(shí)對(duì)3D打印技術(shù)也非常重視。
2015年2月28日,工信部發(fā)布《國(guó)家增材制造產(chǎn)業(yè)發(fā)展推進(jìn)計(jì)劃(2015—2016年)》,提出到2016年中國(guó)要初步建立較完善的增材制造產(chǎn)業(yè)體系,整體技術(shù)水平保持與國(guó)際同步。
2015年5月19日,國(guó)務(wù)院印發(fā)《中國(guó)制造2025》規(guī)劃,明確將3D打印產(chǎn)業(yè)作為發(fā)展重點(diǎn)。
2015年9月,中國(guó)首個(gè)3D打印人體植入物——人工髖關(guān)節(jié)產(chǎn)品獲得國(guó)家食品藥品監(jiān)督管理總局注冊(cè)批準(zhǔn),一時(shí)引發(fā)了眾多關(guān)注。
到目前為止,中國(guó)有四款產(chǎn)品通過(guò)了CFDA認(rèn)證,分別是:愛(ài)康醫(yī)療與北醫(yī)三院合作的3D打印髖臼杯、3D打印人工椎體、3D打印脊柱椎間融合器,以及邁普醫(yī)學(xué)的3D打印硬腦(脊)膜補(bǔ)片。
但是,中國(guó)目前在3D打印醫(yī)療器械方面仍然監(jiān)管不足,缺乏相關(guān)的審批認(rèn)證制度方案。

管理制度滯后,累及醫(yī)療3D產(chǎn)業(yè)健康發(fā)展
自2014年《醫(yī)療器械監(jiān)督管理?xiàng)l例》(以下簡(jiǎn)稱《條例》)修訂以來(lái),國(guó)家發(fā)布了眾多配套部門規(guī)章以及規(guī)范性文件,基于醫(yī)療器械產(chǎn)品全生命周期初步構(gòu)建了全程管理體系。該管理體系以醫(yī)療器械的質(zhì)量管理為重心,以醫(yī)療器械法規(guī)體系和技術(shù)標(biāo)準(zhǔn)為兩大管理依據(jù)。但是,目前針對(duì)3D打印醫(yī)療器械的管理依據(jù)基本處于空白狀態(tài)。
首先,對(duì)于非傳統(tǒng)制造工藝生產(chǎn)的3D打印醫(yī)療器械,管理部門積累的監(jiān)管經(jīng)驗(yàn)極少,對(duì)它的生產(chǎn)經(jīng)營(yíng)以及使用的管理實(shí)踐還很欠缺,要在短時(shí)間內(nèi)出臺(tái)針對(duì)性的行政管理規(guī)范很難。
其次,嚴(yán)重缺乏相關(guān)技術(shù)標(biāo)準(zhǔn)。技術(shù)標(biāo)準(zhǔn)是醫(yī)療器械企業(yè)進(jìn)行研發(fā)設(shè)計(jì)、檢驗(yàn)檢測(cè)、生產(chǎn)經(jīng)營(yíng)的重要依據(jù)。目前對(duì)于采用3D打印技術(shù)制備的醫(yī)療器械,中國(guó)還沒(méi)有出臺(tái)任何針對(duì)性的國(guó)家標(biāo)準(zhǔn)和行業(yè)標(biāo)準(zhǔn)。這既給相關(guān)企業(yè)對(duì)3D打印醫(yī)療器械的質(zhì)量控制造成很大的困難,也給監(jiān)管部門對(duì)3D打印醫(yī)療器械的技術(shù)審評(píng)帶來(lái)很大的障礙。
再次,一些醫(yī)療器械質(zhì)量管理規(guī)范如《醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范》(醫(yī)療器械GCP)、《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》(醫(yī)療器械GMP)、《醫(yī)療器械經(jīng)營(yíng)質(zhì)量管理規(guī)范》(醫(yī)療器械GSP),主要適用于采用傳統(tǒng)制造工藝生產(chǎn)的醫(yī)療器械,缺乏對(duì)3D打印醫(yī)療器械質(zhì)量管理的指引內(nèi)容。
技術(shù)評(píng)價(jià)受限,影響上市審批進(jìn)展
目前,對(duì)3D打印醫(yī)療器械進(jìn)行技術(shù)評(píng)價(jià),不論是企業(yè)還是監(jiān)管部門都存在不少的困難。
第一,對(duì)3D打印醫(yī)療器械進(jìn)行管理,首先要解決的問(wèn)題是它的分類。3D打印醫(yī)療器械的結(jié)構(gòu)特征和使用形式有別于傳統(tǒng)工藝生產(chǎn)的醫(yī)療器械,難以運(yùn)用以往的分類經(jīng)驗(yàn)來(lái)判斷產(chǎn)品風(fēng)險(xiǎn)的高低。因此要對(duì)其進(jìn)行嚴(yán)格的分類比較困難。目前,CFDA將定制增材制造(3D打印)骨科植入物等8類產(chǎn)品收錄到《需進(jìn)行臨床試驗(yàn)審批的第三類醫(yī)療器械目錄》中。
第二,就企業(yè)而言,3D打印設(shè)備與使用的材料是關(guān)系到產(chǎn)品質(zhì)量的兩大因素。隨著3D打印設(shè)備的進(jìn)步,打印材料也從無(wú)生物相容性的材料拓展到了活性細(xì)胞、蛋白及其他細(xì)胞外基質(zhì)。對(duì)于不同的打印材料,質(zhì)量控制有不同的關(guān)注點(diǎn)。
第三,就監(jiān)管部門而言,采用3D打印技術(shù)制備的標(biāo)準(zhǔn)化醫(yī)療器械,制造工藝和材料的安全有效性是技術(shù)審評(píng)的重點(diǎn)。3D打印醫(yī)療器械的技術(shù)審評(píng)應(yīng)該在審評(píng)方法、程序、重點(diǎn)關(guān)鍵點(diǎn)上與傳統(tǒng)醫(yī)療器械不同,但目前還沒(méi)有相關(guān)的規(guī)定出臺(tái)。
由此可見(jiàn),由于對(duì)逐層加工這種嶄新的制造技術(shù)研究尚淺,對(duì)該技術(shù)制備醫(yī)療器械的全生命周期缺乏深入探索,對(duì)終產(chǎn)品的有效檢測(cè)檢驗(yàn)手段尚不明晰,對(duì)產(chǎn)品制造過(guò)程的驗(yàn)證、確認(rèn)過(guò)程以及放行方式尚處于探索階段,相關(guān)企業(yè)及其監(jiān)管部門對(duì)3D打印醫(yī)療器械的技術(shù)評(píng)價(jià)還有一段較長(zhǎng)的路要走,也會(huì)影響產(chǎn)品的上市審批進(jìn)展。
3D打印融合器行業(yè)目前現(xiàn)狀分析
統(tǒng)計(jì)數(shù)據(jù)顯示,2017年中國(guó)3D打印融合器市場(chǎng)規(guī)模4149.50萬(wàn)元,到2021年中國(guó)3D打印融合器市場(chǎng)規(guī)模8411.19萬(wàn)元,增長(zhǎng)率18.99 %。2017-2022年中國(guó)3D打印融合器市場(chǎng)規(guī)模如下:

△圖表:2017-2022年中國(guó)3D打印融合器市場(chǎng)規(guī)模
數(shù)據(jù)來(lái)源:智研瞻產(chǎn)業(yè)研究院整理
打印融合器產(chǎn)業(yè)鏈分析

△圖表:3D打印融合器產(chǎn)業(yè)鏈
資料來(lái)源:智研瞻產(chǎn)業(yè)研究院整理
3D打印融合器行業(yè)發(fā)展面臨的風(fēng)險(xiǎn)
中國(guó)醫(yī)療3D打印面臨的政策困境
對(duì)比國(guó)外,中國(guó)其實(shí)對(duì)3D打印技術(shù)也非常重視。
2015年2月28日,工信部發(fā)布《國(guó)家增材制造產(chǎn)業(yè)發(fā)展推進(jìn)計(jì)劃(2015—2016年)》,提出到2016年中國(guó)要初步建立較完善的增材制造產(chǎn)業(yè)體系,整體技術(shù)水平保持與國(guó)際同步。
2015年5月19日,國(guó)務(wù)院印發(fā)《中國(guó)制造2025》規(guī)劃,明確將3D打印產(chǎn)業(yè)作為發(fā)展重點(diǎn)。
2015年9月,中國(guó)首個(gè)3D打印人體植入物——人工髖關(guān)節(jié)產(chǎn)品獲得國(guó)家食品藥品監(jiān)督管理總局注冊(cè)批準(zhǔn),一時(shí)引發(fā)了眾多關(guān)注。
到目前為止,中國(guó)有四款產(chǎn)品通過(guò)了CFDA認(rèn)證,分別是:愛(ài)康醫(yī)療與北醫(yī)三院合作的3D打印髖臼杯、3D打印人工椎體、3D打印脊柱椎間融合器,以及邁普醫(yī)學(xué)的3D打印硬腦(脊)膜補(bǔ)片。
但是,中國(guó)目前在3D打印醫(yī)療器械方面仍然監(jiān)管不足,缺乏相關(guān)的審批認(rèn)證制度方案。

△湖南華翔與華曙高科聯(lián)合開(kāi)發(fā)多孔型椎間融合器
管理制度滯后,累及醫(yī)療3D產(chǎn)業(yè)健康發(fā)展
自2014年《醫(yī)療器械監(jiān)督管理?xiàng)l例》(以下簡(jiǎn)稱《條例》)修訂以來(lái),國(guó)家發(fā)布了眾多配套部門規(guī)章以及規(guī)范性文件,基于醫(yī)療器械產(chǎn)品全生命周期初步構(gòu)建了全程管理體系。該管理體系以醫(yī)療器械的質(zhì)量管理為重心,以醫(yī)療器械法規(guī)體系和技術(shù)標(biāo)準(zhǔn)為兩大管理依據(jù)。但是,目前針對(duì)3D打印醫(yī)療器械的管理依據(jù)基本處于空白狀態(tài)。
首先,對(duì)于非傳統(tǒng)制造工藝生產(chǎn)的3D打印醫(yī)療器械,管理部門積累的監(jiān)管經(jīng)驗(yàn)極少,對(duì)它的生產(chǎn)經(jīng)營(yíng)以及使用的管理實(shí)踐還很欠缺,要在短時(shí)間內(nèi)出臺(tái)針對(duì)性的行政管理規(guī)范很難。
其次,嚴(yán)重缺乏相關(guān)技術(shù)標(biāo)準(zhǔn)。技術(shù)標(biāo)準(zhǔn)是醫(yī)療器械企業(yè)進(jìn)行研發(fā)設(shè)計(jì)、檢驗(yàn)檢測(cè)、生產(chǎn)經(jīng)營(yíng)的重要依據(jù)。目前對(duì)于采用3D打印技術(shù)制備的醫(yī)療器械,中國(guó)還沒(méi)有出臺(tái)任何針對(duì)性的國(guó)家標(biāo)準(zhǔn)和行業(yè)標(biāo)準(zhǔn)。這既給相關(guān)企業(yè)對(duì)3D打印醫(yī)療器械的質(zhì)量控制造成很大的困難,也給監(jiān)管部門對(duì)3D打印醫(yī)療器械的技術(shù)審評(píng)帶來(lái)很大的障礙。
再次,一些醫(yī)療器械質(zhì)量管理規(guī)范如《醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范》(醫(yī)療器械GCP)、《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》(醫(yī)療器械GMP)、《醫(yī)療器械經(jīng)營(yíng)質(zhì)量管理規(guī)范》(醫(yī)療器械GSP),主要適用于采用傳統(tǒng)制造工藝生產(chǎn)的醫(yī)療器械,缺乏對(duì)3D打印醫(yī)療器械質(zhì)量管理的指引內(nèi)容。
技術(shù)評(píng)價(jià)受限,影響上市審批進(jìn)展
目前,對(duì)3D打印醫(yī)療器械進(jìn)行技術(shù)評(píng)價(jià),不論是企業(yè)還是監(jiān)管部門都存在不少的困難。
第一,對(duì)3D打印醫(yī)療器械進(jìn)行管理,首先要解決的問(wèn)題是它的分類。3D打印醫(yī)療器械的結(jié)構(gòu)特征和使用形式有別于傳統(tǒng)工藝生產(chǎn)的醫(yī)療器械,難以運(yùn)用以往的分類經(jīng)驗(yàn)來(lái)判斷產(chǎn)品風(fēng)險(xiǎn)的高低。因此要對(duì)其進(jìn)行嚴(yán)格的分類比較困難。目前,CFDA將定制增材制造(3D打印)骨科植入物等8類產(chǎn)品收錄到《需進(jìn)行臨床試驗(yàn)審批的第三類醫(yī)療器械目錄》中。
第二,就企業(yè)而言,3D打印設(shè)備與使用的材料是關(guān)系到產(chǎn)品質(zhì)量的兩大因素。隨著3D打印設(shè)備的進(jìn)步,打印材料也從無(wú)生物相容性的材料拓展到了活性細(xì)胞、蛋白及其他細(xì)胞外基質(zhì)。對(duì)于不同的打印材料,質(zhì)量控制有不同的關(guān)注點(diǎn)。
第三,就監(jiān)管部門而言,采用3D打印技術(shù)制備的標(biāo)準(zhǔn)化醫(yī)療器械,制造工藝和材料的安全有效性是技術(shù)審評(píng)的重點(diǎn)。3D打印醫(yī)療器械的技術(shù)審評(píng)應(yīng)該在審評(píng)方法、程序、重點(diǎn)關(guān)鍵點(diǎn)上與傳統(tǒng)醫(yī)療器械不同,但目前還沒(méi)有相關(guān)的規(guī)定出臺(tái)。
由此可見(jiàn),由于對(duì)逐層加工這種嶄新的制造技術(shù)研究尚淺,對(duì)該技術(shù)制備醫(yī)療器械的全生命周期缺乏深入探索,對(duì)終產(chǎn)品的有效檢測(cè)檢驗(yàn)手段尚不明晰,對(duì)產(chǎn)品制造過(guò)程的驗(yàn)證、確認(rèn)過(guò)程以及放行方式尚處于探索階段,相關(guān)企業(yè)及其監(jiān)管部門對(duì)3D打印醫(yī)療器械的技術(shù)評(píng)價(jià)還有一段較長(zhǎng)的路要走,也會(huì)影響產(chǎn)品的上市審批進(jìn)展。
(責(zé)任編輯:admin)
最新內(nèi)容
- ·最新報(bào)告:全球3D打印醫(yī)療市場(chǎng)迅猛發(fā)展
- ·粘結(jié)劑噴射3D打印廠商峰華卓立2024年?duì)I
- ·一文看懂醫(yī)療3D打印分類(附國(guó)產(chǎn)3D打印
- ·江蘇威拉里今年Q1營(yíng)收破1億元,同比增
- ·VoxelMatters最新報(bào)告:金屬增材制造市
- ·AM Research報(bào)告:3D打印市場(chǎng)規(guī)模到 20
- ·全球3D打印行業(yè)總收入突破1500億元,《
- ·國(guó)內(nèi)金屬3D打印粉材需求大增,信為新材
- ·增材制造軟件市場(chǎng)2025:分析、數(shù)據(jù)和預(yù)
- ·2024年Q4 Xometry3D打印市場(chǎng)收入增長(zhǎng),
推薦內(nèi)容
熱點(diǎn)內(nèi)容
- ·AMR報(bào)告2024年美國(guó)國(guó)防部3D打印直接支
- ·二七浪起龍舒甲打一最佳準(zhǔn)確生肖,詞語(yǔ)
- ·半夜三更合五碼打一正確生肖,成語(yǔ)解釋
- ·春花秋月打一正確生肖,成語(yǔ)解釋落實(shí)
- ·3D打印的未來(lái):2022年發(fā)展趨勢(shì)
- ·定向能沉積(DED)增材制造:物理特性、缺
- ·2023年中國(guó)3D打印行業(yè)發(fā)展現(xiàn)狀及發(fā)展前
- ·普通人如何利用3D打印賺錢?
- ·圖解中國(guó)3D打印發(fā)展現(xiàn)狀及趨勢(shì)
- ·為何LCD 3D打印技術(shù)運(yùn)用越來(lái)越廣泛?


 最新報(bào)告:全球3D打印醫(yī)療
最新報(bào)告:全球3D打印醫(yī)療 粘結(jié)劑噴射3D打印廠商峰華
粘結(jié)劑噴射3D打印廠商峰華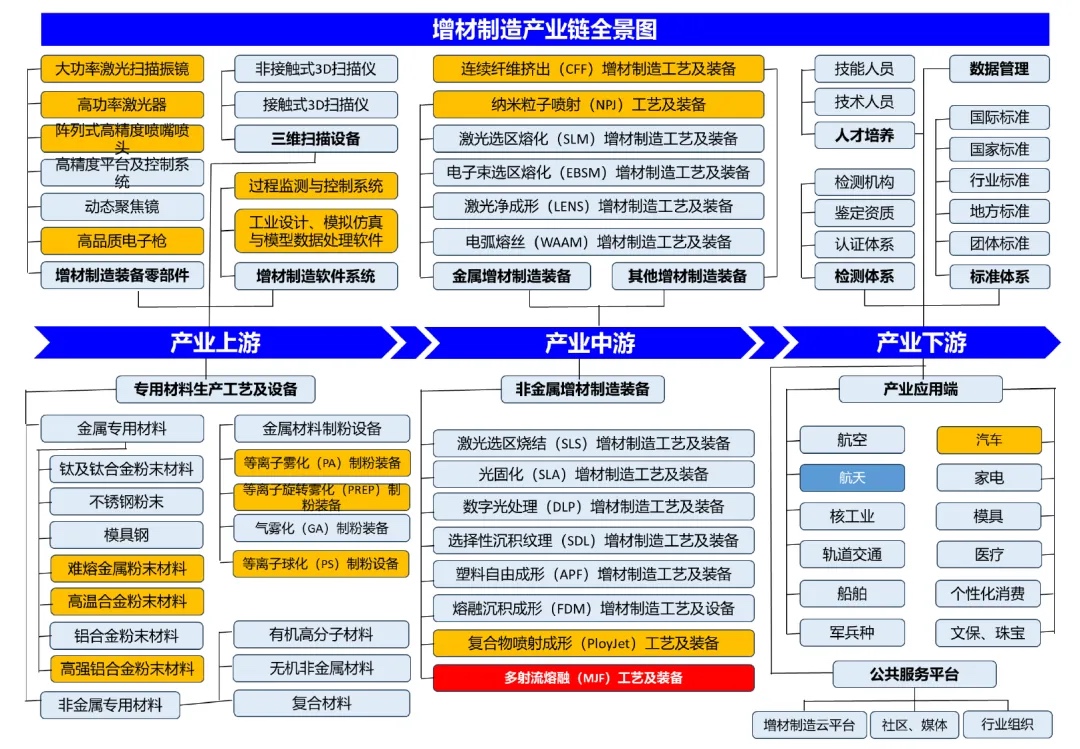 一文看懂醫(yī)療3D打印分類(
一文看懂醫(yī)療3D打印分類( 江蘇威拉里今年Q1營(yíng)收破1
江蘇威拉里今年Q1營(yíng)收破1 VoxelMatters最新報(bào)告:金
VoxelMatters最新報(bào)告:金 AM Research報(bào)告:3D打印
AM Research報(bào)告:3D打印 中南大學(xué)在增材制
中南大學(xué)在增材制 美國(guó)應(yīng)用科學(xué)技術(shù)
美國(guó)應(yīng)用科學(xué)技術(shù) 2023年美國(guó)3D打印
2023年美國(guó)3D打印 淺談3D打印技術(shù)的
淺談3D打印技術(shù)的 據(jù)SmarTech評(píng)估,
據(jù)SmarTech評(píng)估,

