個性化增材制造醫(yī)療器械注冊技術(shù)審查指導(dǎo)原則(2)
表1相關(guān)產(chǎn)品標準
|
標準編號 |
標準名稱 |
|
YY/T 0316-2016 |
《醫(yī)療器械 風(fēng)險管理對醫(yī)療器械的應(yīng)用》 |
|
ISO 17296-2:2015 |
Additive manufacturing -- General principles -- Part 2: Overview of process categories and feedstock |
|
ISO 17296-3:2014 |
Additive manufacturing -- General principles -- Part 3: Main characteristics and corresponding test methods |
|
ISO 17296-4:2014 |
Additive manufacturing -- General principles -- Part 4: Overview of data processing |
|
ASTM F2924-12 |
Standard Specification for Additive Manufacturing Titanium-6 Aluminum-4 Vanadium with Powder Bed Fusion |
|
ASTM F3001-14 |
Standard Specification for Additive Manufacturing Titanium-6 Aluminum-4 Vanadium ELI(Extra Low Interstitial)with Powder Bed Fusion |
|
ASTM F3091/F3091M-14 |
Standard Specification for Powder Bed Fusion of Plastic Materials |
|
ASTM F3049-14 |
Standard Guide for Characterizing Properties of Metal Powders Used for Additive Manufacturing Processes |
|
ISO/ASTM 52921:2013 |
Standard terminology for additive manufacturing -- Coordinate systems and test methodologies |
|
ISO/ASTM 52915:2016 |
Specification for additive manufacturing file format(AMF)Version 1.2 |
|
ISO/ASTM 52901:2017 |
Additive manufacturing -- General principles -- Requirements for purchased AM parts |
|
ISO/ASTM 52900:2015 |
Additive manufacturing -- General principles – Terminology |
(七)產(chǎn)品適用范圍/預(yù)期用途
描述產(chǎn)品具體的使用部位、適用人群、使用情形、適應(yīng)癥和禁忌癥、預(yù)期使用環(huán)境。明確操作該產(chǎn)品應(yīng)當具備的技能/知識/培訓(xùn)。說明預(yù)期與申報產(chǎn)品配合使用的醫(yī)療器械的型號規(guī)格。
(八)產(chǎn)品風(fēng)險分析資料
根據(jù)YY/T 0316-2016《醫(yī)療器械 風(fēng)險管理對醫(yī)療器械的應(yīng)用》,充分識別產(chǎn)品的個性化設(shè)計、原材料采購、生產(chǎn)加工過程、產(chǎn)品包裝、滅菌、運輸、貯存、使用等產(chǎn)品生命周期內(nèi)各個環(huán)節(jié)的安全特征,從生物學(xué)危險(源)、環(huán)境危險(源)、有關(guān)使用的危險(源)、功能失效、能量危險(源)(若涉及)、老化及存儲不當引起的危險(源)等方面,對產(chǎn)品進行全面的風(fēng)險分析,并詳述所采取的風(fēng)險控制措施。
提供產(chǎn)品上市前對其風(fēng)險管理活動進行全面評審所形成的風(fēng)險管理報告,此報告旨在說明并承諾風(fēng)險管理計劃已被恰當?shù)貙嵤⒔?jīng)過驗證后判定綜合剩余風(fēng)險是可接受的,已有恰當?shù)姆椒ǐ@得產(chǎn)品設(shè)計、制造、出廠后流通和臨床應(yīng)用的相關(guān)信息。
風(fēng)險管理報告應(yīng)當包括風(fēng)險分析、風(fēng)險評價、風(fēng)險控制等產(chǎn)品風(fēng)險管理的相關(guān)資料,至少應(yīng)當包括產(chǎn)品安全特征清單、產(chǎn)品可預(yù)見的危害及危害分析清單(說明危害、可預(yù)見事件序列即危害成因分析)、危害處境和可能發(fā)生的損害之間的關(guān)系、風(fēng)險評價、風(fēng)險控制措施以及剩余風(fēng)險評價匯總表。
(九)產(chǎn)品的研究要求
至少應(yīng)當包含如下內(nèi)容:
1.材料表征
結(jié)合材料屬性和工藝流程,分別表征打印前、打印后和終產(chǎn)品材料的化學(xué)成分和組成、微觀結(jié)構(gòu)、力學(xué)性能等,明確各項性能指標的符合標準。
2.產(chǎn)品結(jié)構(gòu)和機械性能
表征產(chǎn)品的結(jié)構(gòu)。例如采用體視學(xué)方法、Micro-CT等表征3D打印多孔結(jié)構(gòu),明確關(guān)鍵特征參數(shù),如孔單元形態(tài)、孔徑大小及其分布、絲徑、孔隙率、平均孔隙截距、孔隙漸變梯度、內(nèi)部連通性、多孔結(jié)構(gòu)的厚度等。
根據(jù)醫(yī)療器械的材料屬性和預(yù)期用途,應(yīng)當進行產(chǎn)品動靜態(tài)力學(xué)性能測試,如剛度、屈服強度、極限強度、蠕變/粘彈性、疲勞和磨損等。個性化增材制造產(chǎn)品可以采用與傳統(tǒng)制造工藝產(chǎn)品相同的測試方法,可根據(jù)產(chǎn)品適用的相關(guān)指導(dǎo)原則、標準要求確定需要的功能試驗項目、試驗方法。
應(yīng)當使用等效模型進行機械試驗。等效模型應(yīng)當與申報產(chǎn)品經(jīng)過所有相同的打印、打印后處理、清洗、滅菌等工藝步驟,且滿足臨床預(yù)期的結(jié)構(gòu)和尺寸要求。提供等效模型確定的合理性論證,如使用3D計算機模擬(如有限元分析)等方法。
3.生物相容性
申報產(chǎn)品的生物相容性評價應(yīng)當按照GB/T 16886.1—2011《醫(yī)療器械生物學(xué)評價 第1部分:風(fēng)險管理過程中的評價與試驗》中的系統(tǒng)方法框圖及《國家食品藥品監(jiān)督管理局關(guān)于印發(fā)醫(yī)療器械生物學(xué)評價和審查指南的通知》(國食藥監(jiān)械〔2007〕345號)中的審查要點進行風(fēng)險評價,在缺乏相關(guān)數(shù)據(jù)時,應(yīng)當進行必要的生物相容性試驗。
4.清洗和滅菌
清洗工藝驗證和滅菌工藝驗證應(yīng)當根據(jù)產(chǎn)品特點選擇最差情況,如清洗工藝驗證中考慮材料殘留,滅菌工藝驗證中考慮表面積、孔隙率、孔徑等影響微生物負載的因素。論證清洗驗證方法的有效性,必要時應(yīng)當采用破壞性試驗對其清洗方法進行驗證。考慮到增材制造工藝的復(fù)雜性,其多孔結(jié)構(gòu)的清洗工藝驗證應(yīng)當由注冊申請人完成。
對于經(jīng)輻照滅菌的產(chǎn)品,需明確輻照劑量及相關(guān)的驗證報告,具體的劑量確定依據(jù)可參照GB 18280系列標準。對于經(jīng)環(huán)氧乙烷滅菌的產(chǎn)品,需提供滅菌結(jié)果確認和過程控制報告,具體可參照GB 18279系列標準。對于經(jīng)濕熱滅菌的產(chǎn)品,需提供滅菌工藝參數(shù)及驗證報告,具體可參考GB 18278系列標準。
對于非滅菌包裝的終產(chǎn)品,應(yīng)當明確推薦采用的滅菌方法并提供確定依據(jù),建議參考WS310.2-2016《醫(yī)院消毒供應(yīng)中心 第2部分:清洗消毒及滅菌技術(shù)操作規(guī)范》。采用其他滅菌方法的應(yīng)當提供方法合理性論證和工藝確認及過程控制報告。
5.產(chǎn)品有效期和包裝
申報產(chǎn)品應(yīng)當參照現(xiàn)行有效的《無源植入性醫(yī)療器械貨架有效期注冊申報資料指導(dǎo)原則(2017年修訂版)》(國家食品藥品監(jiān)督管理總局通告2017年第75號)提供產(chǎn)品貨架有效期的驗證資料。貨架有效期驗證資料中需要明確滅菌產(chǎn)品的包裝材料、包裝工藝及方法、加速老化試驗或/和實時老化試驗報告。加速老化試驗中應(yīng)明確試驗溫度、濕度、加速老化時間的確定依據(jù)。老化試驗后需要對包裝完整性和包裝強度的評價試驗,如染色液穿透試驗、氣泡試驗、材料密封強度試驗、模擬運輸?shù)取H羯暾埲颂峁┢渌t(yī)療器械產(chǎn)品的貨架有效期驗證資料,則應(yīng)當提供其與本次申報產(chǎn)品在原材料、滅菌方法、滅菌劑量、包裝材料、包裝工藝、包裝方式及其它影響阻菌性能的因素方面具有等同性的證明資料。不同包裝、不同滅菌方式的產(chǎn)品應(yīng)當分別提供驗證資料。
對于非滅菌產(chǎn)品,貨架有效期的確定應(yīng)當建立在科學(xué)試驗的基礎(chǔ)上,如穩(wěn)定性試驗,其目的是考察產(chǎn)品在溫度、濕度、光線的影響下隨時間變化的規(guī)律,為產(chǎn)品的生產(chǎn)、包裝、貯存、運輸條件提供科學(xué)依據(jù),同時通過試驗建立產(chǎn)品的有效期。因此,申請人在申報產(chǎn)品注冊時應(yīng)當提供產(chǎn)品有效期的驗證報告及內(nèi)包裝材料信息。
(責(zé)任編輯:admin)


 MGA醫(yī)療聯(lián)盟:以系統(tǒng)化思
MGA醫(yī)療聯(lián)盟:以系統(tǒng)化思 國家統(tǒng)計局:中國3D打印設(shè)
國家統(tǒng)計局:中國3D打印設(shè) ICC將制定混凝土3D打印墻
ICC將制定混凝土3D打印墻 三項增材制造金屬粉末國家
三項增材制造金屬粉末國家 工信部等新規(guī):工業(yè)級3D打
工信部等新規(guī):工業(yè)級3D打 2027年產(chǎn)值突破1500億元(
2027年產(chǎn)值突破1500億元( 洞察2023:全球藥
洞察2023:全球藥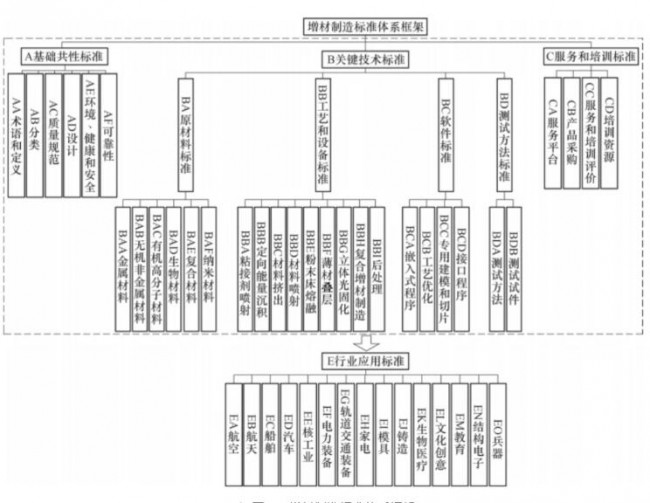 3D打印-增材制造
3D打印-增材制造 《智能制造知識體
《智能制造知識體 2021年中國及31省
2021年中國及31省 全球工程標準協(xié)會
全球工程標準協(xié)會 毛孔的SLM金屬3D
毛孔的SLM金屬3D

